Orbitali atomici , che sono funzioni matematiche, descrivono il comportamento ondulatorio degli elettroni (o coppie di elettroni) in un atomo. Gli orbitali atomici hanno forme diverse a seconda del loro tipo. Le diverse forme degli orbitali atomici descrivono che esiste la probabilità più alta o nulla di trovare un elettrone attorno al nucleo in alcune direzioni. Esistono quattro tipi di orbitali, ciascuno con una forma diversa e rappresentato dalle lettere s, p, d ed f. Gli orbitali s e p vengono presi in considerazione perché sono i più abbondanti nella chimica chimica e biologica. UN orbitale s ha un nucleo sferico al centro, a orbitale p è a forma di manubrio e quattro dei cinque orbitali d hanno la forma di un quadrifoglio. Il quinto orbitale D ha la forma di un lungo manubrio con una ciambella al centro. Gli orbitali di un atomo sono organizzati in strati o gusci di elettroni.
Cosa sono gli orbitali atomici?
Gli orbitali atomici sono lo spazio tridimensionale vicino al nucleo di un atomo dove la possibilità di scoprire un elettrone è massima.
Un atomo, secondo il modello atomico quantistico, può avere un numero infinito di orbitali. Questi orbitali possono essere classificati in base alla loro dimensione, forma o orientamento. Un orbitale più stretto significa che c’è una migliore probabilità di catturare un elettrone vicino al nucleo. La funzione d'onda orbitale è spesso conosciuta come una funzione matematica utilizzata per esprimere le coordinate di un elettrone. La probabilità di localizzare un elettrone è rappresentata dal quadrato della funzione d'onda orbitale. Questa funzione d'onda aiuta anche nella creazione di diagrammi di superficie limite.
Funzione d'onda orbitale
IL modello atomico quantistico predice che un atomo può avere un'enorme varietà di orbitali. Questi orbitali possono essere raggruppati in base alla loro dimensione, geometria o inclinazione. Una dimensione orbitale ridotta aumenta la probabilità di ottenere un elettrone vicino al nucleo. La funzione matematica utilizzata per rappresentare le coordinate di un elettrone è chiamata funzione d'onda orbitale . La probabilità di scoprire un elettrone è rappresentata dal quadrato della funzione d'onda orbitale.
Possiamo anche utilizzare questa funzione d'onda per creare diagrammi di superficie limite. Possiamo comprendere meglio la forma degli orbitali utilizzando i diagrammi della superficie di confine della densità di probabilità costante per vari orbitali.
alberi divaricati
Forme degli orbitali atomici
Le forme degli orbitali atomici variano. Vale a dire, le distribuzioni di probabilità degli elettroni che descrivono attorno al nucleo sono diverse. Il fatto che gli elettroni in orbitali diversi siano probabilmente localizzati in aree diverse attorno al nucleo genitore e quindi subiscano l’attrazione di quest’ultimo con intensità diverse è uno dei motivi per cui gli orbitali variano in energia. È sorprendente che tutti gli orbitali in un dato guscio dell'atomo di idrogeno abbiano la stessa energia pur avendo forme diverse. Ciò è dovuto all'eliminazione di diversi contributi legati all'energia.
Ma non appena c'è un secondo elettrone, la degenerazione scompare.
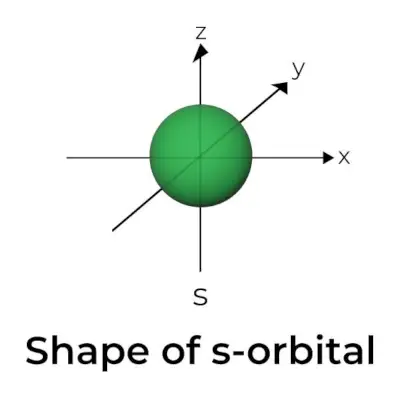
Forma dell'orbitale s
- Il diagramma della superficie del confine orbitale assomiglia ad una sfera con il nucleo al centro, che può essere rappresentato in due dimensioni come un cerchio.
- Gli orbitali s sono sfericamente simmetrici, il che significa che la probabilità di trovare un elettrone a una determinata distanza è la stessa in tutte le direzioni.
- Allo stesso modo è dimostrato che la dimensione dell'orbitale s aumenta all'aumentare del valore del numero quantico primario (n); quindi, 4s> 3s> 2s> 1s.
- Il punto nodale è un luogo dove non c'è alcuna possibilità di localizzare l'elettrone. I nodi sono classificati in due tipi: nodi radiali e nodi angolari. La distanza dal nucleo è calcolata dai nodi radiali, mentre l'orientamento è determinato dai nodi angolari.
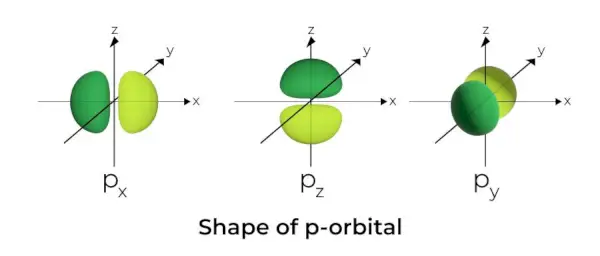
Forma dell'orbitale p
- Gli orbitali p hanno la forma di manubri.
- Il nodo orbitale p si trova al centro del nucleo.
- A causa della presenza di tre orbitali, l'orbitale p può occupare un massimo di sei elettroni.
- Ogni orbitale p è costituito da due parti chiamate lobi che si trovano su entrambi i lati del piano che attraversa il nucleo.
- Ciascun orbitale p ha parti note come lobi su entrambi i lati del piano che attraversa il nucleo. Nel piano in cui i due lobi si intersecano la probabilità di trovare un elettrone è nulla.
- I tre orbitali sono conosciuti come orbitali degeneri perché hanno la stessa dimensione, forma ed energia.
- L'unica differenza tra gli orbitali è l'orientamento dei lobi. Poiché i lobi sono orientati lungo gli assi x, y o z, vengono loro chiamati 2px, 2pi, e 2pz. La formula n –2 viene utilizzata per calcolare il numero di nodi.
- Analogamente agli orbitali s, la dimensione e l'energia degli orbitali p aumentano all'aumentare del numero quantico primario (4p> 3p> 2p).
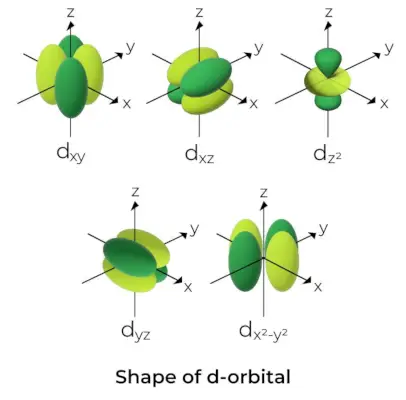
Forma dell'orbitale d
- Per gli orbitali d, il numero quantico dell'orbitale magnetico è dato come (-2,-1,0, 1,2). Di conseguenza, possiamo affermare che esistono cinque orbitali d.
- Questi orbitali sono indicati con i simboli dxy, Dsì, Dxz, DX2-E2, e dCon2.
- Le forme dei primi quattro orbitali d sono simili tra loro, il che differisce dal dCon2orbitale, ma l'energia di tutti e cinque gli orbitali d è la stessa.
Forma dell'orbitale f
- La forma dell'orbitale f è dispersa. Poiché il valore di l=3 per l'orbitale f, il valore minimo del numero quantico primario n è 4.
- I valori ml equivalenti per l'orbitale f sono (-3,–2, –1, 0, +1, +2, +3).
- Di conseguenza, ci sono sette orbitali f per l = 3.

cpld contro fpga
Orbitali degenerati
Gli orbitali degenerati sono quelli con la stessa energia. Questi orbitali sono distinti (possono essere orientati diversamente nello spazio attorno al nucleo atomico ), eppure hanno la stessa energia. In presenza di un campo esterno la degenerazione dell'orbitale p non viene influenzata; tuttavia, la degenerazione degli orbitali f e d può essere interrotta applicando un campo esterno al sistema (campo elettrico o magnetico).
Pochi orbitali avranno un'energia più elevata, mentre altri avranno un'energia inferiore. La degenerazione non esisterà più nel sistema. Ad esempio, gli orbitali d sono costituiti da cinque orbitali degenerati che hanno tutti la stessa energia.
Per saperne di più:
- Teoria degli orbitali molecolari
- Riempimento dell'orbitale in un atomo
- Ibridazione
Domande frequenti sulle forme degli orbitali atomici
Domanda 1: Come funzionano gli orbitali?
Risposta:
Un orbitale atomico è un'espressione matematica che esprime il comportamento ondulatorio di un elettrone o di una coppia di elettroni in un atomo nella teoria atomica e nella meccanica quantistica. Ciascun orbitale occuperà un massimo di due elettroni, ciascuno con la propria quantità di spin.
Domanda 2: Cos'è il piano nodale?
guasto generale di protezione
Risposta:
Il piano in cui la probabilità di trovare un elettrone è trascurabile o nulla è chiamato Piano Nodale.
Domanda 3: Quanti orbitali ci sono?
Risposta:
Poiché il sottolivello s ha un solo orbitale, possono essere presenti solo due elettroni. Poiché il sottolivello p comprende tre orbitali, possono essere presenti al massimo sei elettroni. Poiché il sottolivello d comprende 5 orbitali, possono essere presenti un massimo di 10 elettroni. E ciascuno dei quattro sottolivelli ha sette orbitali che possono contenere un massimo di 14 elettroni.
Domanda 4: quali orbitali hanno l'energia più alta?
array Java dinamico
Risposta:
data locale Java
L'orbitale 1 ha più energia. L’energia di un elettrone è la quantità di energia necessaria per farlo uscire dalla bolla elettrica dell’atomo.
Domanda 5: Qual è la differenza tra un guscio e un orbitale?
Risposta:
In un atomo, un guscio è una raccolta di sottogusci della stessa teoria dei numeri quantici, n. Ciascun orbitale ha due elettroni e gli elettroni nello stesso orbitale hanno la stessa definizione di dimensione, dimensione del momento angolare e numero quantico magnetico.
Domanda 6: Cos'è il legame sigma e pi greco?
Risposta:
La sovrapposizione orbitale atomica crea legami sigma e pi. I legami Sigma vengono creati sovrapponendo i lobi orbitali atomici, mentre i legami Pi vengono generati quando un lobo orbitale atomico si sovrappone a un altro.
