Il principio Aufbau è il metodo di base che ci dice come sono riempiti gli elettroni nell'orbitale atomico. Secondo il principio di Aufbau, il riempimento degli elettroni nello stato fondamentale di un atomo segue uno schema fondamentale. Questo principio ci dice che gli elettroni nell'orbitale atomico di qualsiasi atomo sono riempiti nell'ordine ascendente della loro energia e per trovare l'energia dell'orbitale atomico seguono la regola n+l.
Principio di struttura
In questo articolo impareremo il principio Aufbau, le caratteristiche del principio Aufbau, le sue eccezioni e limitazioni in dettaglio.
Definizione del principio di struttura
Lo afferma il principio di Aufbau
Gli elettroni nei diversi orbitali vengono riempiti in ordine crescente della loro energia, cioè l'orbitale con l'energia più bassa verrà riempito per primo e l'orbitale con l'energia più alta verrà riempito per ultimo.
La parola “Aufbau” in tedesco significa “costruire”. La formazione degli orbitali significa riempire gli orbitali con gli elettroni. Afferma che gli elettroni negli orbitali atomici sono riempiti nell'ordine ascendente dell'energia dell'orbitale atomico. E l'energia dell'orbitale atomico viene calcolata utilizzando la regola n+l che stabilisce se l'elettrone con un numero più alto del valore n+l ha l'energia più alta. Nella regola discussa nella riga precedente, N indica il numero quantico principale e l indica il numero quantico azimutale.
Se due elettroni hanno lo stesso valore di n+l allora l'elettrone con un valore minore di N ha l'energia più piccola e si riempie per primo. L'ordine di riempimento degli elettroni in un orbitale atomico è discusso di seguito.
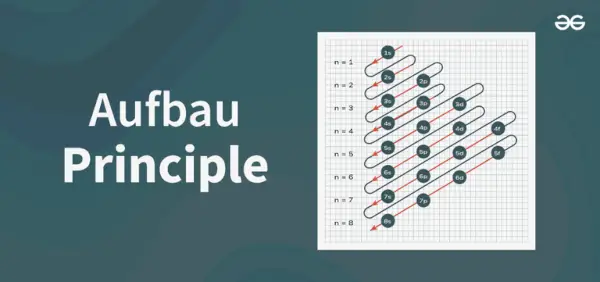
Struttura del diagramma di principio
Il diagramma del principio di Aufbau è il diagramma che descrive l'ordine di riempimento degli elettroni in un atomo.
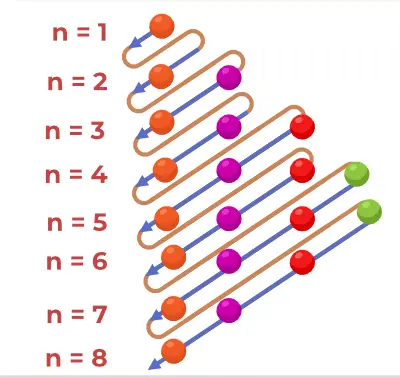
Struttura del diagramma di principio
Struttura della formula principale
La formula del principio di Aufbau è la formula che indica l'ordine in cui gli elettroni sono riempiti nell'orbitale atomico. La formula dell'orbitale atomico è
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p…….
Struttura della classe di principi 11
Il Principio Aufbau è un principio importante di Chimica per gli studenti della classe 11. Questo principio afferma che,
Gli elettroni nell'orbitale atomico di un atomo sono riempiti nell'ordine crescente dell'energia dell'orbitale atomico che viene calcolato utilizzando la regola (n+l).
Disegnare il diagramma della struttura
Il diagramma Aufbau viene disegnato utilizzando i passaggi aggiunti di seguito,
- Trova il numero di elettroni che devono essere riempiti negli atomi.
- Sappiamo che in un atomo il
- L'orbitale s può contenere un massimo di 2 elettroni.
- L'orbitale p può contenere un massimo di 6 elettroni.
- L'orbitale d può contenere un massimo di 10 elettroni.
- L'orbitale f può contenere un massimo di 14 elettroni.
- Inserisci i primi due elettroni nell'orbitale 1s.
- Quindi segui la regola n+l e poi riempi gli elettroni di conseguenza.
Caratteristiche salienti del principio di struttura
Varie caratteristiche del principio Aufbau sono:
- L'energia di un orbitale dipende dalla somma dei valori del numero quantico principale (n) e del numero somma azimutale (I). Questo è chiamato il (n + l) regola . Secondo questa regola,
- In un atomo neutro isolato, minore è il valore di (n + l) per un orbitale, minore è la sua energia. Tuttavia, se due diversi tipi di orbitali hanno lo stesso valore (n + l), allora gli orbitali con un valore di n inferiore hanno meno energia.
| Tipo di orbitale | Valore di n | Valore di l | Valore di n+l | Energia relativa |
|---|---|---|---|---|
| 1 secondo | 1 | 0 | 1+0 = 1 | Energia più bassa |
| 2s | 2 | 0 | 2+0 = 2 | Energia superiore all'orbitale 1s |
| 2p 3s | 2 3 | 1 0 | 2+1 = 3 aggiunta di stringhe in Java 3+0 = 3 | Gli orbitali 2p(n=2) hanno un'energia inferiore rispetto all'orbitale 3s(n=3). |
| 3 p 4s | 3 4 | 1 0 | 3+1 = 4 4+0 = 4 | Gli orbitali 3p(n=3) hanno un'energia inferiore rispetto agli orbitali 4s(n=4). |
| 3d 4p | 3 4 | 2 1 | 3+2 = 5 4+1 = 5 | Gli orbitali 3d (n=3) hanno un'energia inferiore rispetto agli orbitali 4p (n=4). |
Dalla descrizione riportata nella tabella risulta che le energie dei vari orbitali aumentano all'aumentare del numero quantico principale.
- Quindi l'ordine in cui gli elettroni sono riempiti nell'orbitale atomico del atomo È, 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p…
Configurazione elettronica utilizzando il principio Aufbau
IL configurazione elettronica l'utilizzo del principio Aufbau per alcuni elementi è discusso di seguito:
Configurazione elettronica dello zolfo
Numero atomico di Zolfo è 16, cioè ha 16 elettroni
Ora, utilizzando il principio Aufbau, la configurazione elettronica dello zolfo è scritta come:
[S] = 1s 2 2s 2 2p 6 3s 2 3 p 4
Configurazione elettronica dell'azoto
Il numero atomico dell'azoto è 7, cioè ha 7 elettroni
Ora, utilizzando il principio Aufbau, la configurazione elettronica dell'azoto è scritta come:
[N] = 1s 2 2s 2 2p 3
Eccezioni al principio di costruzione
Ci sono alcune eccezioni al principio Aufbau che sono il cromo e il rame. La loro configurazione elettronica è,
Configurazione elettronica di Chromium
La configurazione elettronica di Chromium dovrebbe essere secondo il principio Aufbau
- Cr(24): [Ar]3d 4 4s 2
Ma la configurazione di cui sopra non è corretta perché l'effettiva configurazione elettronica del Cromo(Cr) è:
- Cr(24): [Ar]3d 5 4s 1
La ragione di questa configurazione elettronica è che il l'orbitale d-atomico riempito a metà è più stabile dell'orbitale riempito secondo il principio Aufbau.
Configurazione elettronica del rame
La configurazione elettronica del Rame secondo il Principio Aufbau dovrebbe essere:
- Cu(29): [Ar]3d 9 4s 2
La configurazione di cui sopra non è corretta perché l'effettiva configurazione elettronica del rame (Cu) è:
- Cu(29): [Ar]3d 10 4s 1
La ragione di questa configurazione elettronica è che il l'orbitale d-atomico pieno è più stabile dell'orbitale riempito secondo il principio Aufbau.
Per saperne di più
- Numeri quantistici
- Forma degli orbitali atomici
- Struttura atomica
Principio della struttura: domande frequenti
Cos'è il principio Aufbau in chimica?
Il principio Aufbau in chimica è il principio di base utilizzato per riempire gli elettroni negli orbitali atomici di qualsiasi atomo. Questo teorema ci dice l'ordine in cui gli elettroni sono occupati nell'orbitale atomico.
Chi ha dato il principio Aufbau?
Il principio Aufbau fu formulato dal famoso fisico danese Niels Bohr nel 1920.
Qual è il principio di esclusione di Pauli?
Il principio di esclusione di Pauli afferma che in un atomo non esistono due elettroni che abbiano tutti e quattro i numeri quantici T lui stesso. Almeno uno dei numeri quantici è diverso per tutti gli elettroni nell'atomo.
Cos'è la regola n+l?
La regola n+l è la regola che afferma che l'energia di un orbitale dipende dalla somma del Numero Quantico Principale(n) e del Numero Quantico Azimutale(l). questa regola è chiamata regola (n+l).
Quali sono le eccezioni al principio Aufbau?
Le eccezioni al principio Aufbau sono:
- Configurazione elettronica del cromo Cr[24]
- Configurazione elettronica del rame Cu[29]
