Il concetto di ibridazione è definito come il processo di combinazione di due orbitali atomici per creare un nuovo tipo di orbitali ibridati. Questa mescolanza si traduce tipicamente nella formazione di orbitali ibridi con energie, forme e così via completamente diverse. L'ibridazione viene effettuata principalmente da orbitali atomici dello stesso livello energetico. Tuttavia, sia gli orbitali completamente pieni che quelli semipieni possono partecipare a questo processo se le loro energie sono uguali. Il concetto di ibridazione è un’estensione della teoria del legame di valenza che ci aiuta a comprendere la formazione dei legami, le energie dei legami e le lunghezze dei legami.
Cos'è l'ibridazione?
Quando due orbitali atomici si combinano per formare un orbitale ibrido in una molecola, l'energia degli orbitali dei singoli atomi viene ridistribuita per fornire orbitali di energia equivalente. Questo è noto come ibridazione.
Gli orbitali atomici di energie comparabili vengono mescolati insieme durante il processo di ibridazione, che comporta principalmente la fusione di due orbitali o due orbitali 'p' o la miscelazione di un orbitale 's' con un orbitale 'p' e un orbitale 's'. orbitale con un orbitale 'd'.
Orbitali ibridi sono i nuovi orbitali formati come risultato di questo processo. Ancora più importante, gli orbitali ibridi possono essere utilizzati per spiegare le proprietà di legame atomico e la geometria molecolare. Il carbonio, ad esempio, forma quattro legami singoli in cui l'orbitale del guscio di valenza si combina con tre orbitali p del guscio di valenza. Questa combinazione genera quattro sp equivalenti3miscele. Questi saranno disposti secondo uno schema tetraedrico attorno al carbonio, che è legato a quattro atomi diversi.
Passaggi per determinare il tipo di ibridazione
Per comprendere il tipo di ibridazione in un atomo o in uno ione è necessario seguire le seguenti regole.
Java con altalena
- Innanzitutto, determinare il numero totale di elettroni di valenza contenuti in un atomo o ione.
- Quindi, conta il numero di coppie solitarie attaccate a quell'atomo o ione.
- Ora, il numero di orbitali richiesti può essere calcolato aggiungendo il numero di duplex o ottetto e il numero di coppie solitarie di elettroni.
- Va notato che la geometria degli orbitali negli atomi o negli ioni è diversa quando non esiste una coppia solitaria di elettroni.
Caratteristiche dell'ibridazione
- L'ibridazione avviene tra orbitali atomici con uguali energie.
- Il numero di orbitali ibridi formati è uguale al numero di orbitali atomici che si mescolano.
- Non è necessario che tutti gli orbitali riempiti a metà partecipino all'ibridazione. Possono partecipare anche gli orbitali completamente pieni ma con energia leggermente variabile.
- L'ibridazione avviene solo durante la formazione del legame, non in un singolo atomo gassoso.
- Se si conosce l’ibridazione della molecola, è possibile prevederne la forma.
- Il lobo più grande dell'orbitale ibrido è sempre positivo, mentre il lobo più piccolo sul lato opposto è sempre negativo.
Tipi di ibridazione
L'ibridazione può essere classificata come sp3, sp2, sp., sp3d, sp3D2, o sp3D3in base ai tipi di orbitali coinvolti nella miscelazione.
volpe o lupo
sp Ibridazione
Si verifica quando gli orbitali uno s e uno p nel guscio principale di un atomo si combinano per formare due nuovi orbitali equivalenti. Gli orbitali appena formati sono noti come orbitali ibridati sp. Produce molecole lineari con un angolo di 180°. Implica la combinazione del proprio orbitale e di un orbitale “p” di uguale energia per produrre un nuovo orbitale ibrido noto come orbitale ibrido sp.
- È anche conosciuta come ibridazione diagonale.
- Ogni orbitale ibridato sp contiene la stessa quantità di caratteri s e p.
- Tutti i composti del berillio, come BeF2, BeH2e BeCl2, sono esempi.

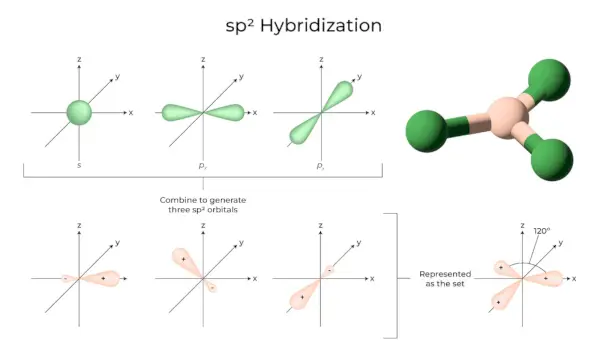
sp2Ibridazione
Si verifica quando gli orbitali uno e due p del guscio dello stesso atomo si combinano per formare tre orbitali equivalenti. Gli orbitali appena formati sono conosciuti come sp2orbitali ibridi. È anche conosciuta come ibridazione trigonale. Si tratta di combinare il proprio orbitale con due orbitali “p” di uguale energia per creare un nuovo orbitale ibrido noto come sp2. Una miscela di simmetria trigonale di orbitali s e p è mantenuta a 120 gradi. Tutti e tre gli orbitali ibridi rimangono sullo stesso piano e formano tra loro un angolo di 120°.
- Ogni orbitale ibrido formato ha un carattere 'p' per il 33,33% e per il 66,66%.
- Le molecole di forma planare triangolare hanno un atomo centrale che è legato ad altri tre atomi ed è sp2ibridato. I composti del boro sono esempi.
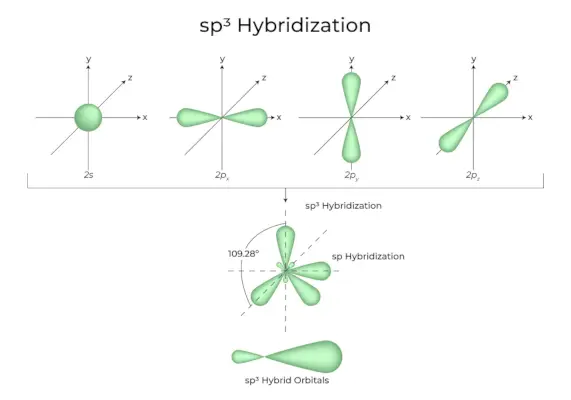
sp3Ibridazione
Quando un orbitale 's' e tre orbitali 'p' dello stesso guscio di un atomo si combinano per formare quattro nuovi orbitali equivalenti, l'ibridazione è nota come ibridazione tetraedrica o sp3. Gli orbitali appena formati sono conosciuti come sp3orbitali ibridi. Questi sono appuntiti ai quattro angoli di un tetraedro regolare e formano tra loro un angolo di 109°28′.
- La sp3gli orbitali ibridi formano un angolo di 109,28 gradi.
- Ogni orbitale ibrido ha il 25% di carattere s e il 75% di carattere p.
- Etano e metano sono due esempi.
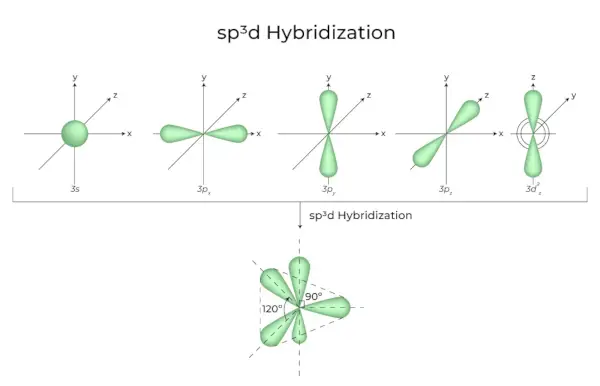
sp3d Ibridazione
La miscelazione di orbitali 1s, orbitali 3p e orbitali 1d si traduce in orbitali ibridi 5 sp3d di uguale energia. La loro geometria è bipiramidale trigonale. La combinazione degli orbitali s, p e d si traduce in una simmetria bipiramidale trigonale. Gli orbitali equatoriali sono tre orbitali ibridi orientati tra loro con un angolo di 120° e che giacciono sul piano orizzontale.
- I restanti due orbitali, noti come orbitali assiali, si trovano nel piano verticale a 90 gradi del piano degli orbitali equatoriali.
- L'ibridazione in pentacloruro di fosforo, ad esempio (PCl5).
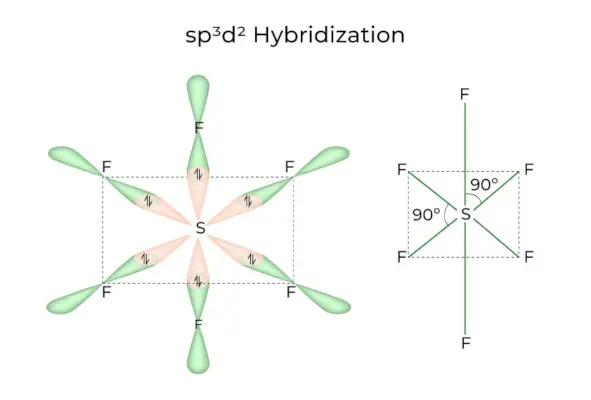
sp3D2 Ibridazione
Quando gli orbitali 1s, 3p e 2d si combinano per formare 6 sp identici3D2orbitali ibridi, l'ibridazione è chiamata sp3D2Ibridazione. Questi sette orbitali puntano ai vertici di un ottaedro. Sono inclinati di 90 gradi l'uno rispetto all'altro.
contare mq distinti
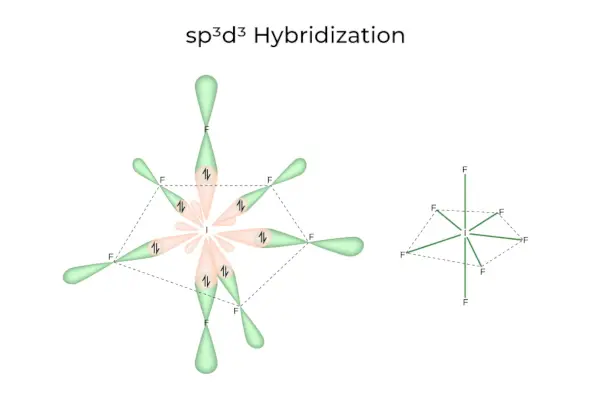
sp3D3Ibridazione
Ha orbitali 1s, 3p e 3d, che si combinano per formare 7 sp identici3D3orbitali ibridi. Questi sette orbitali puntano agli angoli di una bipiramide pentagonale. per esempio. SE6.
Forme di ibridazione
- Lineare: l'ibridazione sp è causata dall'interazione di gruppi a due elettroni; l'angolo orbitale è 180°. Planare trigonale: sono coinvolti tre gruppi elettronici, risultando in sp2ibridazione; gli orbitali sono distanti 120°. Tetraedrico: sono coinvolti quattro gruppi elettronici, risultando in sp3ibridazione; l'angolo orbitale è 109,5°. Bipiramidale trigonale: sono coinvolti cinque gruppi elettronici, risultando in sp3d ibridazione; gli angoli orbitali sono 90° e 120°. Ottaedrico: sono coinvolti sei gruppi elettronici, risultando in sp3D2ibridazione; gli orbitali sono distanti 90°.
Domande frequenti su Ibridazione
Domanda 1: Tra sp, sp2 e sp3, quale orbitale ibrido è più elettronegativo?
Risposta:
La percentuale del carattere s in sp, sp2, e sp3il carbonio ibridato è rispettivamente del 50%, 33,33% e 25%. A causa della forma sferica dell'orbitale s, viene attratto uniformemente dal nucleo da tutte le direzioni. Di conseguenza, un orbitale ibrido di carattere s sarà più vicino al nucleo e quindi più elettronegativo. Di conseguenza, il carbonio ibridato sp è il più elettronegativo.
Domanda 2: cosa sono gli orbitali ibridi?
Risposta:
programma java ciao
Gli orbitali ibridi si formano combinando orbitali atomici standard e determinando la formazione di nuovi orbitali atomici.
Domanda 3: Quali sono le cinque forme di ibridazione?
Risposta:
Lineare, trigonale planare, tetraedrica, trigonale bipiramidale e ottaedrica sono le cinque forme base di ibridazione.
Domanda 4: Perché la molecola di ammide assomiglia a sp3ibridato ma è sp2?
dove si trovano le impostazioni del browser
Risposta:
Se l'atomo è racchiuso da due o più orbitali p o ha una coppia solitaria in grado di saltare in un orbitale p, il processo generale di ibridazione cambierà. Di conseguenza, nel caso di una molecola di ammide, la coppia solitaria entra in un orbitale p, risultando in tre orbitali p paralleli adiacenti.
Domanda 5: Qual è la regola di Bent?
Risposta:
Un atomo centrale collegato a numerosi gruppi in una molecola si ibriderà, facendo sì che gli orbitali con più carattere s siano diretti verso gruppi elettropositivi e gli orbitali con più carattere p siano diretti verso gruppi elettronegativi.
