IL Tavola periodica degli elementi è una disposizione sistematica di 118 elementi chimici conosciuti. Questi elementi chimici sono organizzati in ordine di numero atomico crescente. Le righe orizzontali da sinistra a destra sono chiamate periodi mentre le colonne verticali dall'alto verso il basso sono chiamate gruppi in una tavola periodica.
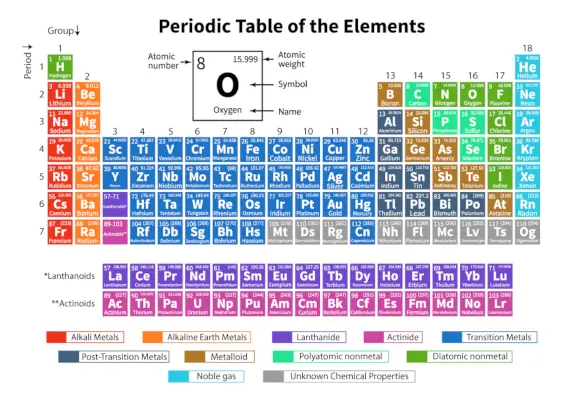
Tabella dei contenuti
- Cos'è la tavola periodica?
- Elenco degli elementi della tavola periodica
- Termini importanti nella tavola periodica
- Classificazione degli elementi nella tavola periodica
- Tavola periodica di Mendeleev
- Domande frequenti sulla tavola periodica degli elementi
Cos'è la tavola periodica?
Una tavola periodica è una rappresentazione tabellare in cui tutti gli elementi chimici conosciuti sono disposti in righe orizzontali chiamate periodi e colonne verticali chiamate gruppi in base alla loro numero atomico e la struttura atomica rispettivamente.
È una disposizione di tutti gli elementi conosciuti e quindi fornisce informazioni sugli elementi come la loro massa, il numero di elettroni, la configurazione elettronica e le loro proprietà chimiche uniche.
Elenco degli elementi della tavola periodica
Ecco la tabella che rappresenta 118 elementi della tavola periodica. Gli elementi elencati sono organizzati secondo l'ordine crescente del numero atomico e del rispettivo peso atomico, simbolo, densità ed elettronegatività.
| Elementi della tavola periodica con massa atomica | |||||
|---|---|---|---|---|---|
| Numero atomico | Nome dell'elemento chimico | Simbolo | Massa atomica (amu) | Densità (g/cm 3 ) | Elettronegatività |
| 1 | Idrogeno | H | 1.0079 | 0.00008988 | 2.2 |
| 2 | Elio | Lui | 4.0026 | 0,0001785 | – |
| 3 | Litio | Quello | 6.941 | 0,534 | 0,98 |
| 4 | Berillio | Essere | 9.0122 | 1,85 | 1.57 |
| 5 | Boro | B | 10.811 | 2.34 | 2.04 |
| 6 | Carbonio | C | 12.0107 | 2.267 | 2,55 |
| 7 | Azoto | N | 14.0067 | 0,0012506 | 3.04 |
| 8 | Ossigeno | O | 15.9994 | 0,001429 | 3.44 |
| 9 | Fluoro | F | 18.9984 | 0,001696 | 3,98 |
| 10 | Neon | SÌ | 20.1797 | 0,0009002 | – |
| undici | Sodio | Già | 22.9897 | 0,968 | 0,93 |
| 12 | Magnesio | Mg | 24.305 | 1.738 | 1.31 |
| 13 | Alluminio | Al | 26.9815 | 2.7 | 1.61 |
| 14 | Silicio | Sì | 28.0855 | 2.329 | 1.9 |
| quindici | Fosforo | P | 30.9738 | 1.823 | 2.19 |
| 16 | Zolfo | S | 32.065 | 2.07 | 2.58 |
| 17 | Cloro | Cl | 35.453 | 0,0032 | 3.16 |
| 18 | Argon | Con | 39.948 | 0,001784 | – |
| 19 | Potassio | K | 39.0983 | 0,89 | 0,82 |
| venti | Calcio | Quello | 40.078 | 1,55 | 1 |
| ventuno | Scandio | SC | 44.9559 | 2.985 | 1.36 |
| 22 | Titanio | Di | 47.867 | 4.506 | 1.54 |
| 23 | Vanadio | IN | 50.9415 | 6.11 | 1.63 |
| 24 | Cromo | Cr | 51.9961 | 7.15 | 1.66 |
| 25 | Manganese | Mn | 54.938 | 7.21 | 1,55 |
| 26 | Ferro | Fede | 55.845 | 7.874 | 1.83 |
| 27 | Cobalto | Co | 58.9332 | 8.9 | 1,88 |
| 28 | Nichel | In | 58.6934 | 8.908 | 1.91 |
| 29 | Rame | Con | 63.546 | 1.9 | 60 |
| 30 | Zinco | Zn | 65.39 | 1,65 | 70 |
| 31 | Gallio | Qui | 69.723 | 1.81 | 19 |
| 32 | Germanio | Ge | 72.64 | 2.01 | 1.5 |
| 33 | Arsenico | COME | 74.9216 | 2.18 | 1.8 |
| 3.4 | Selenio | LUI | 78,96 | 2,55 | 0,05 |
| 35 | Bromo | Fratello | 79.904 | 2.96 | 2.4 |
| 36 | Krypton | NO | 83.798 | 3 | 1×10−4 |
| 37 | Rubidio | Rb | 85.4678 | 0,82 | 90 |
| 38 | Stronzio | sr | 87.62 | 0,95 | 370 |
| 39 | Ittrio | E | 88.906 | 1.22 | 33 |
| 40 | Zirconio | Zr | 91.224 | 1.33 | 165 |
| 41 | Niobio | N.B | 92.906 | 1.6 | venti |
| 42 | Molibdeno | Mo | 95,94 | 2.16 | 1.2 |
| 43 | Tecnezio | Tc | 98 | 1.9 | ~ 3×10−9 |
| 44 | Rutenio | Ru | 101.07 | 2.2 | 0,001 |
| Quattro cinque | rodio | Rh | 102.91 | 2.28 | 0,001 |
| 46 | Palladio | Pd | 106.42 | 2.2 | 0,015 |
| 47 | Argento | A | 107,87 | 1.93 | 0,075 |
| 48 | Cadmio | CD | 112.411 | 1,69 | 0,159 |
| 49 | Indio | In | 114.82 | 1,78 | 0,25 |
| cinquanta | Credere | Sn | 118,71 | 1,96 | 23 |
| 51 | Antimonio | Sb | 121,76 | 2.05 | 0,2 |
| 52 | Tellurio | IL | 127,6 | 2.1 | 0,001 |
| 53 | Iodio | IO | 126.9045 | 2.66 | 0,45 |
| 54 | Xeno | Auto | 131.293 | 2.6 | 3×10−5 |
| 55 | Cesio | Cs | 132,91 | 0,79 | 3 |
| 56 | Bario | Non | 137.327 | 0,89 | 425 |
| 57 | Lantanio | IL | 138,91 | 1.1 | 39 |
| 58 | Cerio | Questo | 140.12 | 1.12 | 66,5 |
| 59 | Praseodimio | Il prof | 140.9077 | 1.13 | 9.2 |
| 60 | Neodimio | ND | 144.24 | 1.14 | 41,5 |
| 61 | Promezio | PM | 145 | 1.13 | 2×10−19 |
| 62 | Samario | Sm | 150,36 | 1.17 | 7.05 |
| 63 | Europio | Unione Europea | 151.964 | 1.2 | 2 |
| 64 | Gadolinio | Dio | 157,25 | 1.2 | 6.2 |
| 65 | Terbio | Tb | 158.9253 | 1.2 | 1.2 |
| 66 | Disprosio | Quelli | 162,5 | 1.22 | 5.2 |
| 67 | Olmio | A | 164.9303 | 1.23 | 1.3 |
| 68 | Erbio | È | 167.259 | 1.24 | 3.5 |
| 69 | Tulio | Tm | 168.9342 | 1.25 | 0,52 |
| 70 | Itterbio | Sì | 173.04 | 1.1 | 3.2 |
| 71 | Parigi | Lu | 174.967 | 1.27 | 0,8 |
| 72 | Afnio | HF | 178,49 | 1.3 | 3 |
| 73 | Tantalio | Di fronte | 180.9479 | 1.5 | 2 |
| 74 | Tungsteno | IN | 183,84 | 2.36 | 1.3 |
| 75 | Renio | Rif | 186.207 | 1.9 | 7×10−4 |
| 76 | Osmio | Voi | 190.23 | 2.2 | 0,002 |
| 77 | Iridio | E | 192.22 | 2.2 | 0,001 |
| 78 | Platino | Pt | 195.08 | 2.28 | 0,005 |
| 79 | Oro | A | 196,97 | 2.54 | 0,004 |
| 80 | Mercurio | Hg | 200,59 | 2 | 0,085 |
| 81 | Tallio | Tl | 204.3833 | 1.62 | 0,85 |
| 82 | Guida | Pb | 207.2 | 1,87 (2+) 2,33 (4+) | 14 |
| 83 | Bismuto | Con un | 208.9804 | 2.02 | 0,009 |
| 84 | Polonio | Dopo | 209 | 2 | 2×10−10 |
| 85 | Astato | A | 210 | 2.2 | 3×10−20 |
| 86 | Radon | Rn | 222 | 2.2 | 4×10−13 |
| 87 | Francio | Fr | 223 | >0,79[6] | ~1×10−18 |
| 88 | Radio | Sole | 226 | 0.9 | 9×10−7 |
| 89 | Attinio | E | 227 | 1.1 | 5,5×10−10 |
| 90 | Torio | Gi | 232.0381 | 1.3 | 9.6 |
| 91 | Protoattinio | BENE | 231.0359 | 1.5 | 1,4×10−6 |
| 92 | Uranio | IN | 238.0289 | 1.38 | 2.7 |
| 93 | Nettuno | Per esempio | 237 | 1.36 | ≤ 3×10−12 |
| 94 | Plutonio | Potevo | 244 | 1.28 | ≤ 3×10−11 |
| 95 | Americio | Sono | 243 | 1.13 | – |
| 96 | Curio | Cm | 247 | 1.28 | – |
| 97 | Berkelio | Bk | 247 | 1.3 | – |
| 98 | California | Cfr | 251 | 1.3 | – |
| 99 | Einsteinio | È | 252 | 1.3 | – |
| 100 | Fermio | FM | 257 | 1.3 | – |
| 101 | Mendeleev | Md | 258 | 1.3 | – |
| 102 | Nobile | NO | 259 | 1.3 | – |
| 103 | Lawrence | Lr | 262 | 1.3 | – |
| 104 | Rutherfordio | Rif | 267 | – | – |
| 105 | Dubbio | Db | 268 | – | – |
| 106 | Seaborgio | Sg | 269 | – | – |
| 107 | Bohrio | Mah | 270 | – | – |
| 108 | Hassium | Hs | 269 | – | – |
| 109 | Meitnerio | Monte | 277 | – | – |
| 110 | Darmstadio | Ds | 281 | – | – |
| 111 | Roentgenio | Rg | 282 | – | – |
| 112 | Copernico | Cn | 285 | – | – |
| 113 | Nihonium | Nh | 286 | – | – |
| 114 | Flerovium | In | 290 | – | – |
| 115 | Mosca | Mc | 290 | – | – |
| 116 | Livermorio | Liv | 293 | – | – |
| 117 | Tennessee | Ts | 294 | – | – |
| 118 | Oganesson | E | 294 | – | – |
Termini importanti nella tavola periodica
| Termini Java ottiene l'ora corrente | Descrizione |
|---|---|
| Numero atomico | Il numero di protoni che costituisce il nucleo di un elemento è chiamato numero atomico (Z). per esempio. Il carbonio contiene quindi 6 protoni, quindi il suo numero atomico deve essere solo 6. |
| Massa atomica | È definita come la massa media degli atomi di un elemento. Si misura sulla base dell'abbondanza naturale relativa degli isotopi dell'elemento. Massa atomica è anche chiamato peso atomico (A). Si misura nell'unità di massa atomica (amu). |
| Periodo | Le righe orizzontali da sinistra a destra in una tavola periodica sono chiamate Periodi. Ci sono un totale di 7 periodi nella tavola periodica. Gli elementi sono disposti orizzontalmente a causa delle loro somiglianze nelle proprietà, come gli stessi orbitali atomici e così via. |
| Gruppo | Le colonne verticali dall'alto al basso in una tavola periodica sono chiamate Gruppi. Nella tavola periodica ci sono complessivamente 18 gruppi. Gli elementi sono disposti verticalmente a causa delle loro somiglianze nelle proprietà, poiché contengono lo stesso numero di elettroni di valenza. |
| Simbolo di un elemento | Un simbolo è una nozione utilizzata per rappresentare un elemento chimico utilizzando una lettera o una combinazione di due o tre lettere. per esempio. Il simbolo chimico del Carbonio è C, mentre Fe è usato per il Ferro e così via. |
Classificazione degli elementi nella tavola periodica
I 118 elementi sono organizzati in 7 periodi e 18 gruppi come mostrato sopra. Inoltre, gli elementi sono divisi in diversi blocchi.
| Bloccare | Elementi inclusi | Ultimo subshell elettronico riempito |
|---|---|---|
| blocco s | Gruppo 1 (metalli alcalini) | s-sottoshell |
| Gruppo 2 (Metalli alcalino terrosi) | ||
| blocco p | Gruppo 13 (Famiglia Boro) | sottoshell p |
| Gruppo 14 (Famiglia del Carbonio) | ||
| Gruppo 15 (Famiglia dell'azoto) | ||
| Gruppo 16 (Famiglia dell'Ossigeno) | ||
| Gruppo 17 (Famiglia del fluoro) | ||
| blocco D | Gruppi da 3 a 12 (Elementi di transizione) | d-sottoshell |
| blocco f | Lantanidi (elementi delle terre rare) | sottoshell f |
| Attinidi |
Tavola periodica di Mendeleev
Per rappresentare somiglianze e tendenze nel comportamento degli elementi, Mendeleev sviluppò la tavola periodica, che è una disposizione degli elementi in un ordine crescente di massa atomica in forma tabellare.

Secondo la tavola periodica di Mendeleev, gli elementi erano organizzati in base alle loro proprietà fondamentali, alla massa atomica e alle caratteristiche chimiche. All’epoca del lavoro di Mendeleev si conoscevano solo 63 elementi. Nella tavola periodica di Mendeleev, la riga orizzontale e le colonne verticali venivano chiamate rispettivamente gruppi e periodi.
Tuttavia, la tavola periodica di Mendeleev fallisce a causa di molti difetti. Alcuni di essi sono che non sono stati designati l'idrogeno e i gas nobili. Inoltre, l’ordine crescente della massa atomica degli elementi non era regolare in tutta la tabella. Anche la scoperta degli isotopi viola la legge periodica di Mendeleev.
Per saperne di più:
- Tavola periodica moderna
- Tavola periodica di Mendeleev
- Legge periodica moderna
- Storia della tavola periodica
- Struttura atomica
Domande frequenti sulla tavola periodica degli elementi
Cos'è la tavola periodica degli elementi?
La tavola periodica degli elementi è una disposizione tabellare di elementi chimici organizzati in base al numero atomico, alla configurazione elettronica e alle proprietà chimiche ricorrenti. La tabella è divisa in righe chiamate periodi e colonne chiamate gruppi o famiglie.
Chi ha scoperto la tavola periodica degli elementi?
La tavola periodica degli elementi non fu scoperta da una sola persona, ma il suo sviluppo è attribuito a Dmitri Mendeleev, un chimico russo, che organizzò gli elementi in base alle loro proprietà nel 1869.
Chi ha realizzato la tavola periodica moderna?
Nel 1913, Henry Moseley introdusse una versione aggiornata della tavola periodica, comunemente chiamata tavola periodica moderna.
Come è organizzata la tavola periodica?
La tavola periodica è organizzata in ordine crescente di numero atomico, con elementi raggruppati insieme in base a proprietà chimiche simili e disposti in periodi (righe) e gruppi (colonne).
Cos'è il numero atomico?
Il numero di protoni che costituisce il nucleo di un elemento è chiamato numero atomico (Z). per esempio. Il carbonio contiene quindi 6 protoni, il suo numero atomico deve essere solo 6.
Possono due elementi diversi avere lo stesso numero atomico?
Il numero di neutroni in un atomo di due elementi diversi può essere simile, ma il numero di protoni non sarà mai lo stesso. Ogni elemento ha un numero specifico di protoni, che corrisponde al numero di atomi.
Come calcolare la massa atomica?
La massa atomica può essere calcolata sommando la massa dei protoni e dei neutroni presenti in un elemento.
Cos'è un gruppo nella tavola periodica?
La Colonna nella tavola periodica si riferisce al gruppo della tavola periodica. Gli elementi dello stesso gruppo hanno proprietà fisiche e chimiche simili.
