La base è un composto chimico costituito da OH–ioni e accetta protoni. Le basi in chimica sono quei composti che diventano rossi tornasole blu e quando reagiscono con l'acido neutralizzano la reazione per dare sale e acqua. Il valore del pH della base è maggiore di 7. Le basi hanno un sapore amaro e un tocco scivoloso. Le basi solubili in acqua sono chiamate alcali. Esempi di basi sono ossidi metallici, idrossidi metallici, ecc. Il sapone è un esempio di base che usiamo nella vita quotidiana. In questo articolo impareremo in dettaglio la definizione, le proprietà e le reazioni chimiche delle basi.

Definizione di base
La base è definita come il composto chimico il cui valore di pH è maggiore di 7, accetta un protone, neutralizza l'acido e trasforma la cartina di tornasole rossa in blu. Generalmente liberano OH–ione sulla dissociazione. Gli esempi includono NaOH, NaHCO3,ecc. Di seguito sono riportate alcune caratteristiche generali mostrate dalla base:
- Hanno un sapore amaro
- Sono scivolosi al contatto
- Diventano rossi tornasole blu
- Liberano OH–ione quando disciolto in acqua
- Conducono l'elettricità sotto forma di soluzione
Le basi sono uno dei composti chimici più importanti utilizzati nella vita di tutti i giorni. Le basi vengono utilizzate come antiacido per controllare l'acidità e nei dentifrici per neutralizzare l'azione batterica che produce acido nella nostra bocca e previene la degradazione dello smalto e della cavità. Sono anche usati come lievito, bicarbonato di sodio e detersivo.
Base Lewis
Le basi di Lewis sono i composti che hanno una coppia di elettroni e possono donarla ai composti che sono carenti di coppie di elettroni. Le basi di Lewis sono di natura nucleofila, cioè amano i nuclei, il che significa che attaccheranno un centro carico positivamente con le loro coppie di elettroni. Esempi di base Lewis includono l'ammoniaca perché nell'ammoniaca (NH3) l'atomo centrale di azoto ha 5 elettroni di cui 3 vengono utilizzati per creare legami con 3 atomi di idrogeno e una coppia di elettroni rimane con l'atomo di N formando così NH3una base Lewis.
Base Arrhenius
Secondo il concetto di Arrhenius, le basi sono composti che rilasciano ioni idrossido quando disciolti in acqua e aumentano la concentrazione di ioni idrossile nella soluzione acquosa. Ad esempio, quando KOH viene sciolto in acqua darà OH–ione e quindi aumentare la concentrazione di OH–in acqua.
Base Bronsted
Il concetto di base di Bronsted è una versione avanzata del concetto di Arrhenius che afferma che le basi sono composti che accettano H+ione o protone per formare il loro acido coniugato. Ad esempio Cl–è una base che accetta H+per formare HCl come acido coniugato.
Tipi di basi
Le basi possono essere classificate in base all’acidità, alla concentrazione e alla capacità di ionizzazione. La classificazione è menzionata di seguito
Tipi di basi in base all'acidità
L'acidità di una base si riferisce al numero di gruppi idrossilici sostituibili presenti in una molecola della base. In base all'acidità, le basi sono classificate in tre categorie:
- Base monoacida
- Base diacidica
- Base triacida
Monoacido: Le basi monoacidiche sono quelle che contengono un solo ione ossidrile sostituibile e interagiscono con un solo ione idrogeno. Le basi monoacidiche includono NaOH, KOH e altre.
Diacidico: La base diacidica è una base con due ioni ossidrile sostituibili che interagiscono con due ioni idrogeno. Ca(OH)2,Mg(OH)2, e altre basi diacide sono esempi.
Triacido: La base triacida è un tipo di base che comprende tre ioni ossidrile sostituibili e tre ioni idrogeno. Le basi triacide includono Al(OH)3, Fe(OH)3, e altri.
Tipi di basi in base alla loro concentrazione in soluzione acquosa
La concentrazione si riferisce alla quantità di base presente in una soluzione acquosa. In base alla loro concentrazione in soluzione acquosa, le basi si dividono in due categorie:
- Base concentrata
- Base diluita
Base concentrata: Le basi concentrate sono quelle in cui la quantità di base è maggiore rispetto al solvente. Soluzione concentrata di NaOH, ad esempio.
Base diluita: Questi tipi di basi hanno una concentrazione di base inferiore nella loro soluzione acquosa. La diluizione è il processo di riduzione della percentuale di soluto aggiungendo una maggiore quantità di solvente. Ad esempio, diluire NaOH, diluire KOH e così via.
Tipi di basi in base al grado di ionizzazione
Il grado di ionizzazione si riferisce alla capacità di un composto chimico di liberare il proprio ione costituente quando disciolto in acqua. Nel caso della Base, il grado di ionizzazione si riferisce alla capacità della base di rilasciare OH–ioni quando sono disciolti in acqua. In base al grado di ionizzazione, le basi si classificano in due tipologie:
- Base forte
- Base debole
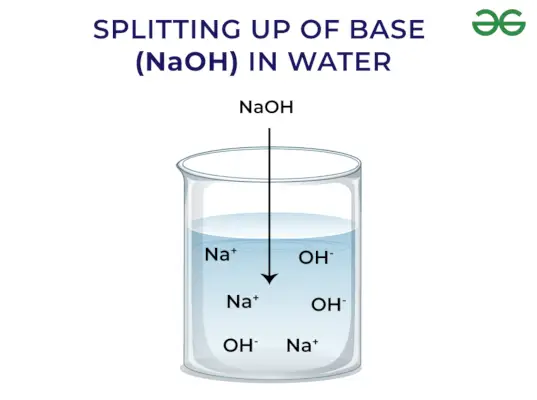
Base forte: Le basi forti sono quelle basi che si dissociano completamente e liberano ioni OH- quando disciolte in acqua. Alcuni esempi di basi forti includono NaOH, KOH, ecc.
Base debole: Le basi che non subiscono la dissociazione completa e liberano solo una frazione di ione OH- sono chiamate basi deboli. Esempi di basi deboli includono Al(OH)3,Cu(OH)2,eccetera.
Saperne di più, Basi forti e deboli
Proprietà delle basi
Poiché sappiamo che le basi sono composti chimici che hanno ione OH-, diventano rossi tornasole blu, ecc. In questa sezione impareremo le proprietà fisiche e chimiche delle basi insieme ad alcune brevi conoscenze delle loro proprietà generali.
Proprietà generali della base
Le proprietà generali delle basi sono menzionate di seguito:
- Uno ione idrossido (OH–) viene rilasciato nell'acqua dalle basi. Più forte diventa la base man mano che vengono rilasciati più ioni.
- Le basi reagiscono con l'acido per formare il sale. Gli acidi reagiscono con le basi. Questa reazione di una base con un acido è chiamata reazione di neutralizzazione.
- Le basi virano dalla cartina di tornasole rossa al blu.
- La struttura di una proteina può essere alterata dalle basi. Le basi hanno questa qualità, che le fa sembrare scivolose. Il sapone è una base che diventa incredibilmente scivolosa sulla pelle quando è bagnata. A causa della loro capacità di modificare la struttura delle proteine, alcune basi potenti sono estremamente pericolose.
Proprietà fisiche delle basi
Le basi hanno gusto Amaro: Le basi hanno un sapore amaro. A causa della sua amarezza, abbiamo solo pochi alimenti alcalini. Ci sono solo pochi materiali alimentari alcalini. Le basi vanno gustate con più cautela rispetto agli acidi.
Le basi sono scivolose al tatto: Quando vengono toccate, le basi sembrano scivolose. Ad esempio il sapone.
Le basi rilasciano OH – Ione: Quando le basi vengono sciolte in acqua rilasciano lo ione ossidrile (OH–). A seconda della capacità di liberare ioni ossidrile vengono classificati come forti e deboli.
Le basi neutralizzano gli acidi: Quando le basi reagiscono con gli acidi, si neutralizzano a vicenda e producono sale e acqua. Questa reazione si chiama Reazione di neutralizzazione . Diciamo che abbiamo l'acido HY e la base 'XOH', quindi il sale formato sarà 'XY'. L'equazione per questa reazione può essere data come HY + XOH → HOH + XY.
Basi Denatura Proteine: La denaturazione delle proteine significa la distruzione della stabilità e della struttura della proteina. Questo fa uso di basi dannose per l'uomo poiché la pelle e i capelli umani sono costituiti da proteine e quando vengono utilizzati alcali forti come l'idrossido di sodio o di potassio, chiamato anche lisciva, creano un impatto dannoso sulla pelle umana.
Le basi trasformano la cartina di tornasole rossa in blu: Quando le basi vengono messe in contatto con la cartina di tornasole rossa, questa diventa blu. Tuttavia, va notato che tale cambiamento non può essere osservato quando proviamo a far reagire la base secca con la cartina al tornasole rossa. Il test della cartina di tornasole è uno dei metodi più antichi per testare la base. Tuttavia esistono anche altri indicatori come la fenolftaleina
Le basi conducono l’elettricità: Quando le basi sono in soluzione hanno ioni OH- mobili quindi possono condurre elettricità.
Proprietà chimiche delle basi
- Reazione della base con i metalli: Quando gli alcali (base) reagiscono con il metallo, si formano sale e idrogeno gassoso.
Alcali + Metallo → Sale + Idrogeno
Esempi:
- Quando l'idrossido di sodio interagisce con l'alluminio metallico, vengono generati alluminato di sodio e idrogeno gassoso.
2 NaOH + 2 Al + 2 H 2 O→2NaAlO 2 + 2 ore 2
- Quando l'idrossido di sodio interagisce con lo zinco metallico, produce gas idrogeno e zincato di sodio.
2 NaOH + Zn → Na 2 ZnO 2 + H 2
- Reazione degli ossidi non metallici con la base: Sale e acqua si formano quando gli ossidi non metallici reagiscono con una base.
Ossido non metallico + Base → Sale + Acqua
lupo o volpe
Quando l'idrossido di calcio, una base viene fatta reagire con l'anidride carbonica, vengono prodotti carbonato di calcio e acqua.
Ca(OH) 2 +CO 2 → CaCO 3 + H 2 O
- Reazione di alcali/base con sali di ammonio: L'ammoniaca viene prodotta quando gli alcali reagiscono con i sali di ammonio.
Alcali + Sale di ammonio → Sale + Acqua + Ammoniaca
Quando l'idrossido di calcio reagisce con il cloruro di ammonio, vengono prodotti acqua di cloruro di calcio e ammoniaca.
Ca(OH) 2 + NH 4 Cl → CaCl 2 + H 2 O+NH 3
Esempi di basi
Le basi generalmente sono Ossido di metallo, Idrossido di metallo, Carbonato di idrogeno metallico, Carbonati di metallo ecc. Vediamo alcuni esempi di basi con la loro applicazione in forma tabellare:
| Basi | Applicazioni |
|---|---|
| Idrossido di potassio KOH | Utilizzato nelle batterie alcaline |
| Idrossido di sodio NaOH | Utilizzato nella produzione di sapone e detersivo |
| Idrossido di magnesio Mg(OH) 2 | Utilizzati come antiacidi |
| Bicarbonato di sodio NaHCO 3 | Utilizzato come bicarbonato di sodio |
| Carbonato di sodio Già 2 CO 3 | Utilizzato come detersivo |
| Ammoniaca NH 3 | Utilizzato nella produzione di prodotti per la pulizia e farmaceutici |
| Idrossido di calcio Ca(OH) 2 | Utilizzato nel lavaggio bianco |
Usi delle basi
Esistono vari casi d'uso di base, alcuni di questi sono:
- L'idrossido di sodio viene utilizzato nella produzione di sapone e carta. L'idrossido di sodio (NaOH) viene utilizzato anche nella produzione del rayon.
- La polvere decolorante è composta da Ca(OH)2, comunemente noto come calce spenta o idrossido di calcio.
- L'idrossido di calcio viene utilizzato per creare miscele secche per la verniciatura e la decorazione.
- L'idrossido di magnesio, popolarmente noto come latte di magnesia, è un lassativo ampiamente utilizzato. Viene anche usato come antiacido poiché diminuisce l'acidità in eccesso nello stomaco umano.
- Nei laboratori, l'idrossido di ammonio è un reagente critico.
- La calce spenta può essere utilizzata per neutralizzare l'eventuale eccesso di acidità nei terreni.
Per saperne di più
- Acido, base e sale
- Forza dell'acido
- Ionizzazione di acidi e basi
Domande frequenti sulle basi in chimica
1. Cosa sono le Basi?
- I composti di base hanno un sapore amaro.
- La texture della maggior parte delle basi è saponosa.
- Se testato su cartina di tornasole, trasforma nella maggior parte dei casi la cartina di tornasole rossa in cartina di tornasole blu.
- In soluzione anche i composti base conducono elettricità.
- Quando i composti basici vengono sciolti in acqua, vengono liberati ioni OH-.
2. Quali sono le funzioni delle basi?
A casa utilizziamo basi come detergenti e antiacidi. Saponi, liscivia (che viene utilizzata nei detergenti per il forno), latte di magnesia e Tums sono tutti esempi di basi popolari fatte in casa. Ciascuno di essi ha un pH superiore a sette, può consumare idrogeno libero e neutralizzare gli acidi.
3. Qual è la distinzione più importante tra un acido e una base?
Acidi e basi sono due tipi di sostanze chimiche corrosive. I materiali acidi hanno un valore di pH compreso tra 0 e 7, mentre le basi hanno un valore di pH compreso tra 7 e 14. Gli acidi sono sostanze chimiche ioniche che si decompongono in acqua per creare lo ione idrogeno (H+) mentre la base si dissocia per dare ione OH-.
4. Quali sono le proprietà fisiche delle basi?
- Hanno un sapore amaro per loro.
- Le loro soluzioni acquose hanno una qualità saponosa.
- Cambiano il colore della cartina di tornasole dal rosso al blu.
- Le loro soluzioni acquose sono elettricamente conduttive.
- Con il rilascio di idrogeno gassoso, le basi reagiscono con i metalli per generare sale.
5. Cosa accadrà quando l'idrossido di calcio reagisce con il cloruro di ammonio?
Quando l'idrossido di calcio reagisce con il cloruro di ammonio, vengono prodotti acqua di cloruro di calcio e ammoniaca.
Ca(OH) 2 + NH 4 Cl → CaCl 2 + H 2 O+NH 3
6. Cosa accadrà quando l'idrossido di sodio reagisce con lo zinco metallico?
Quando l'idrossido di sodio interagisce con lo zinco metallico, produce gas idrogeno e zincato di sodio.
2 NaOH + Zn → Na 2 ZnO 2 + H 2
7. Cos'è la Base Lewis?
Le basi di Lewis sono i composti che donano una coppia di elettroni al composto carente di elettroni. L'esempio include NH3.
8. Di cosa sono fatte le basi?
Le basi generalmente sono costituite da OH–ione. Oltre a questi ossidi metallici, sono basi anche i carbonati e i carbonati di idrogeno.
9. Cosa sono gli alcali?
Le basi solubili in acqua sono chiamate alcali. Un esempio è l'idrossido di sodio NaOH.
10. Cosa sono la Base Forte e la Base Debole?
Le basi che si dissociano completamente per dare OH–gli ioni che si dissolvono in acqua sono chiamati Base Forte. Gli esempi includono NaOH. Le basi deboli sono quelle che non si dissociano completamente per liberare OH–lo ione è detto base debole. Esempi di basi deboli includono l'idrossido di ammonio.
